6月19日,迪哲医药宣布公司的JAK抑制剂戈利昔替尼正式获得国家药品监督管理局(NMPA)批准,适应症为复发/难治外周T细胞淋巴瘤(r/r PTCL),成为全球首个且唯一治疗PTCL的高选择性JAK1抑制剂。
这也意味着迪哲医药在一年的时间内获批了两款全球FIC/BIC的药物,这在本土Biotech中可谓“前无古人”。
1
全球首个且唯一
针对T细胞淋巴瘤的JAK抑制剂
戈利昔替尼是一款新一代口服、高选择性JAK1抑制剂。迪哲通过针对r/r PTCL的差异化适应症布局,获得全球首发优势,开启了一条难有竞争者的赛道。
从数量上看,JAK抑制剂赛道已经十分拥挤,全球进入临床研究阶段的JAK抑制剂已超过100项,但这些药物关注的适应症多集中于自免领域,如类风湿关节炎、重症斑秃等。迪哲医药的戈利昔替尼是其中唯一一款专注于T细胞淋巴瘤的JAK抑制剂。
就临床结果看,戈利昔替尼全面突破治疗瓶颈,为r/r PTCL患者带来更深缓解、全面获益、更长生存。此次获批,是基于全球关键性注册临床(JACKPOT8 B部分)研究成果,经IRC评估,戈利昔替尼单药显示出强效持久的抗肿瘤活性,客观缓解率(ORR)达44.3%,完全缓解(CR)率达23.9%,均是既往靶向治疗方案的近2倍,且在多种PTCL常见亚型中均观察到肿瘤缓解。同时,中位缓解持续时间(mDoR)长达20.7个月,远超现有疗法(小于12个月),可为患者带来更为持久的临床获益,该成果发表于国际知名顶刊《柳叶刀·肿瘤学》。
2022年2月,戈利昔替尼治疗r/r PTCL患者获得FDA授予快速通道认定。该认定将有助于公司大幅提高与FDA的沟通效率,加快戈利昔替尼在美国、欧盟注册的进程。
2
全新作用机制和独特分子设计
改写PTCL十年无好药的窘境
外周T细胞淋巴瘤(PTCL)通常泛指起源于胸腺后的成熟T/NK细胞淋巴瘤,是一组恶性程度高、异质性极强的恶性淋巴细胞增殖性疾病。
PTCL在所有非霍奇金淋巴瘤中生存率最低,大部分PTCL病理亚型的初诊患者会采取的治疗方案是以CHOP为基础的四联化疗。然而,患者初治缓解后仍存在极高的复发风险,生存预后极差,3年生存率仅有23%,中位OS仅5.8个月。
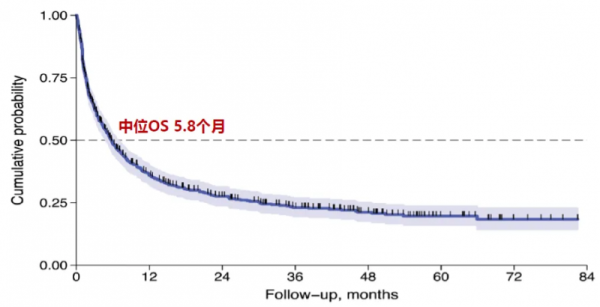
图.复发难治性PTCL中位OS情况
然而,棘手的是,r/r PTCL发病机制复杂,这个领域要做成药很难,而现有药物又均不够理想。既往获批新药单药治疗整体ORR不及30%,CR率不到15%,且无法对各亚型PTCL均有效。
流行病学调查显示,PTCL在亚洲人群中的发病率约是西方人群的两倍。在中国,PTCL发病率占非霍奇金淋巴瘤(NHL)的24.4%,而西方人群这一比例仅为5~10%。根据GLOBOCAN统计数据,中国2020年新发NHL患者人数约为9万,其中PTCL新发患者人数约2万例。
疾病难治且发病率较低的情况下,欧美国家药企缺乏研发动力。可以说,假如中国企业不积极开发,此领域要诞生有效治疗药物可能遥遥无期。跨国药企曾几度尝试突破r/r PTCL,研究都以失败告终。而国内企业最近的尝试,比如嘉禾生物的PD-1杰诺单抗及恒瑞的PI3K林普利塞,也纷纷折戟。
在戈利昔替尼诞生以前的过去十年里,全球范围内没有全面治疗PTCL的创新药成功上市。
迪哲医药从源头开创了靶向JAK/STAT通路治疗PTCL的全新作用机制,填补了既往药物多个亚型的治疗空白。
根据2022年WHO分类标准,PTCL包含39种亚型,我国占比较多的亚型有ENKTCL、PTCL-NOS、AITL,不同亚型具有不同的病理学特征和临床表现,对药物治疗的反应也不尽相同。
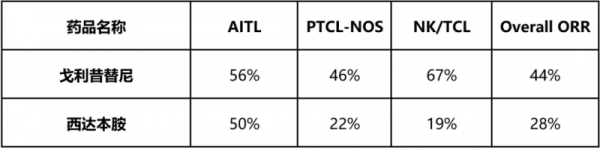
针对r/r PTCL患者,指南推荐首选临床试验,目前推荐级别最高、临床应用较为广泛的治疗药物是2014年在中国获批上市的西达本胺。然而,西达本胺单药治疗r/r PTCL患者ORR为28%,仅对AITL亚型有效,整体疗效有限。
与之相比,戈利昔替单药治疗r/r PTCL带来全面获益,针对多种亚型均表现出显著更高的缓解,填补了既往药物在多个亚型治疗上的空白。
此外,戈利昔替尼独特的创新分子结构,实现对JAK1的极高选择性(选择性相对JAK家族其它成员高200~400倍)和长半衰期(戈利昔替尼在人体内的半衰期可长达近50个小时)。因此,戈利昔替尼能在对肿瘤进行持续抑制的同时,大幅提高治疗安全性和耐受性。
事实上,戈利昔替尼的优秀,已获得重磅指南的认可。
在今年4月举办的2024年CSCO指南大会上,戈利昔替尼凭借优异临床研究数据,提前获得最新发布的《CSCO淋巴瘤诊疗指南(2024版)》Ⅱ级推荐,用于治疗r/r PTCL患者。对于未获批上市的药品,II级推荐已为最高推荐级别,表明血液领域权威专家对戈利昔替尼临床研究质量及疗效的高度认可。
3
持续高效输出源头创新的能力
迪哲医药曾对媒体表示,公司成立伊始就把快速形成自我造血机制作为公司发展的关键一步,公司的研发团队从自身优势领域入手,以最快速度把最有把握的产品推向市场。
PTCL领域里,戈利昔替尼是多个同期开展II期单臂关键性临床研究的产品中首个获批上市的国创新药。
迪哲的高效创新能力从舒沃替尼的研发便开始展现,该药物从国内首例临床研究受试者入组到正式获批上市,仅用时不到4年,超越第三代EGFR-TKI药王奥希替尼在国内的效率(4.5年),树立了源头创新药临床推进速度新标准。
4
差异化FIC/BIC管线
助力公司从中国走向全球
一直以来,迪哲医药通过聚焦源头创新,打造富含FIC/BIC潜力,且极具差异化的管线布局。
公司的首个上市新药舒沃替尼于2023年8月获批,为首款针对EGFR 20号外显子插入突变(exon20ins)晚期非小细胞肺癌(NSCLC)的国创新药。在短短7个月的时间内,舒沃替尼在自费市场就实现销售收入近2亿元,月均销售额更是已逼近同样针对“罕见靶点”且市场规模相当的MET抑制剂——赛沃替尼医保放量后的水平。眼见着肿瘤治疗药物市场的又一国产“爆款”即将登场。
本次戈利昔替尼的获批又成为公司差异化道路的第二块试金石,它不仅为PTCL患者提供了全新治疗选择,更标志着迪哲医药在肿瘤领域的创新研发能力再获认可。
后续管线中,迪哲医药针对B细胞非霍奇金淋巴瘤(B-NHL)的DZD8586也备受关注。BTK抑制剂对部分B-NHL疗效显著,但耐药问题仍是全球性挑战;同时,伴中枢神经系统淋巴瘤(CNSL)的患者预后很差,已上市BTK抑制剂血脑屏障穿透能力有限。作为全球首创可完全穿透血脑屏障的非共价LYN/BTK双靶点抑制剂,DZD8586可有效抑制多种B-NHL亚型细胞的生长,有望克服以上临床难点。
2023年ASH年会上,迪哲公布了DZD8586 针对多种B-NHL的临床数据。研究结果显示,50mg剂量下DZD8586针对多线治疗失败的B-NHL患者ORR达71.4%,其中在(弥漫大 B 细胞淋巴瘤)DLBCL患者中,ORR高达83.3%。针对DLBCL,目前全球尚无BTK抑制剂获批。DZD8586极具FIC/BIC潜力,这或是迪哲又一次“不走寻常路”策略的胜利。
着眼未来,迪哲医药正加速其国际化步伐,推进产品海外上市,为全球病患带来更多治疗选择与希望。
结语
戈利昔替尼的获批,不仅仅只是为r/r PTCL患者带来更多生的希望,也在一定程度上承载了我国创新药研发历史上里程碑意义。同时,也给了国内Biotech更多的启示,与其在同质化靶点的“内卷”里打滚,不如提起勇气差异化布局,做前人所不能做之事,成功或许来得更快。
参考资料:
1、迪哲医药官网、年报、公告等
2、《2024 CSCO指南更新|“新机制”与“新结构”双管齐下,全球首个高选择性JAK1抑3、制剂全面突破PTCL治疗瓶颈》,药事网,2024-05-08
4、《精准医学时代治疗外周T细胞淋巴瘤的新型药物研究进展》,山东第一医科大学(山东省医学科学院)学报[J],2023,44(1):1-9
5、《迪哲医药顺利摘U已不远?》,药渡数据,2023-12-20
申请创业报道,分享创业好点子。点击此处,共同探讨创业新机遇!






